Prinsip Kesetimbangan Kimia
Kesetimbangan Dinamis
Reaksi kimia yang terjadi di alam sering kali tidak mencapai
kesempurnaan. Pada beberapa reaksi, suatu zat bereaksi dengan zat yang lain
membentuk produk yang mana produk tersebut bereaksi lagi membentuk bahan
awalnya.
Dengan demikian, dua reaktan A dan B bisa saja membentuk
produk C dan D. produk C dan D bereaksi lagi membentuk A dan B.
A + B C + D
} Reaksi
yang dapat mempunyai arah maju dan mundur secara bersamaan disebut dengan
reaksi dapat balik (reversible reaction). Keadaan dapat balik diraih
ketika dua reaksi yang berlawanan terjadi pada laju yang sama dan konsentrasi reaktan
dengan produk tidak berubah dengan waktu dan ditemukan pada kesetimbangan
kimia.
Keadaan setimbang adalah keadaan sistem yang sifatnya dapat
diukur tanpa adanya perubahan dalam kondisi tertentu :
} Keadaan
sistem yang dapat diukur menjadi konstan pada keadaan setimbang
} Reaksi
dapat berakhir secara sempurna
} Pada
keadaan setimbang laju reaksi maju sama dengan laju reaksi mundur
} Pada
saat setimbang tidak ada perubahan konsentrasi molekul sistem.
} Sebagai
contoh lihatlah kesetimbangan reaksi antara hidrogen dan bromin pembentuk
hidrogen bromida
Keadaan awal (kiri) dan keadaan setimbang (kanan) pada
reaksi pembentukan hidrogen bromida.
} Ketika
hidrogen dan bromin di tempatkan pada wadah yang tertutup yang dijaga pada
temperatur yang sangat tinggi, molekul hidrogen mulai bereaksi dengan bromin
membentuk hidrogen bromida.
H2(g)
+ Br2(g) 2HBr(g)
Pada waktu yang sama molekul hidrogen bromida juga akan
terdisosiasi menjadi gas hidrogen dan bromin.
2HBr(g)
H2(g) + Br2(g)
SIFAT KESETIMBANGAN DINAMIS
} Perhatikan
reaksi berikut ini :
–
NO2(g) +
CO(g) NO(g) + CO2(g)
Ketika sejumlah NO2 dan CO direaksikan, maka
akan terbentuk produk. Walaupun pembentukan produk selesai reaksi akan tetap
berlanjut sampai tercapai kesetimbangan. Beberapa sifat kesetimbangan dinamis
adalah :
–
Konsentrasi seluruh zat akan selalu konstan pada
temperatur konstan itulah yang disebut dengan kesetimbangan konsentrasi.
–
Kesetimbangan dinamis berupa reaksi dapat balik
dapat stabil antara kedua ruas persamaan reaksi.
— Pada
reaksi H2(g) + Br2(g) 2HBr(g)
kesetimbangan dapat diraih balik pada ruas kiri maupun kanan. Jadi jika 2 mol
hidrogen di reaksikan dengan 2 mol bromin akan didapatkan 4 mol hidrogen
bromida. Atau dengan kata lain 4 mol hidrogen bromida akan membentuk 2 mol
hidrogen dan 2 mol bromin.
Tetapan Kesetimbangan Kimia
— Dalam
keadaan setimbang, perbandingan konsentrasi pereaksi dan hasil reaksi
tergantung pada suhu dan jenis reaksi kesetimbangan. Cato Maximilian
Guldberg dan Peter Waage, dua ahli kimia dari Norwegia, menyatakan bahwa
dalam reaksi kesetimbangan berlaku hukum kesetimbangan.
— Bunyi
Hukum Kesetimbangan :
“Dalam keadaan setimbang pada suhu tertentu, hasil perkalian
konsetrasi hasil reaksi dibagi perkalian konsentrasi pereaksi yang
masing-masing dipangkatan koefisiennya mempunyai nilai konstan.”
— Sementara
itu, tetapan kesetimbangan berdasarkan konsentrasi (Kc) adalah hasil
perkalian konsentrasi hasil reaksi dibagi perkalian konsentrasi pereaksi yang
masing-masing dipangkatkan koefisiennya. Dalam kesetimbangan kimia,
rumusan Kc dihitung dari konsentrasi zat (g) gas dan (Aq) Aquos
yang terlibat dalam reaksi. Sedangkan
zat (s) padat dan (l) cair di abaikan. Perhatikan reaksi berikut.
pA(g)
+ qB(g) rC(g) + sD(g)
Untuk menghitung besar Kc pada
kesetimbangan kimia, dipergunakan rumus berikut :
Kesetimbangan Parsial
— Tetapan
kesetimbangan parsial adalah perbandingan dari hasil kali tekanan parsial
produk berpangkat koefisiennya masing-masing dengan tekanan parsial reaktan
berpangkat koefisiennya masing-masing. Tetapan kestimbangan parsial
disimbolkan "Kp".
dibawah ini adalah rumus Kp :
Hubungan Kc dengan Kp
Reaksi yang melibatkan fasa gas,
nilai Kc dan Kp tidak selalu sama. Misalnya untuk reaksi konseptual fasa gas berikut :
Konsentrasi molar mempunyai
satuan mol per liter larutan, sedangkan tekanan parsial mempunyai satuan
atmosfir. dengan menggunakan lambang n untuk mol; V untuk liter; P untuk
tekanan, dan diandaikan sistem reaksi fasa gas berprilaku gas ideal,maka dengan
memanfaatkan hukum gas ideal:
PV = nRT, kita dapat menentukan
konsentrasi molar suatu gas X dalam campuran yaitu :
Persamaan tersebut disederhanakan
menjadi :
jadi, Kp dan Kc dihubungkan oleh
variabel suhu yang berpangkat perubahan molar fasa gas.





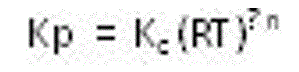

Tidak ada komentar:
Posting Komentar